热点推荐
热门图文
我们的基因组中散布着一种名为逆转录转座子的DNA片段,它们可以从一个位置移动到另一个位置。它们大部分时间在沉睡,但当它们被激活时,其中一些会杀死神经元并促进炎症——这一发现可能会为神经退行性疾病的治疗带来灵感。
Amber Dance | 撰文
蛋炒饭 | 翻译
时间回到2008年,神经病毒学家蕾妮·杜维尔(Renée Douville) 在死于运动神经元疾病——肌萎缩侧索硬化(ALS,俗称“渐冻症”)的患者大脑中,观察到了一个奇怪的物质:病毒蛋白。
但这些人并未感染任何已知的病毒。
但这也并非无迹可寻,造成这一现象的原因是——一些源自病毒的古老基因。这些基因其实早已潜伏在患者自身染色体中,只是突然间“苏醒”了,并开始疯狂制造病毒蛋白。
我们的基因组简直像个散落着“病毒残片”的战场,这些“残片”是数百万年前的病毒感染后遗留下来的。在这些外来的DNA片段中,有一种被称为逆转录转座子 (retrotransposons)的基因序列,它们占据了人类基因组(遗传信息)的40%以上!
在大多数情况下,许多逆转录转座子似乎都安分守己。但杜维尔和其他科学家正在追踪一个令人不安的可能性:某些“苏醒”(重新激活)的逆转录转座子可能造成严重破坏:它们能破坏神经细胞、点燃炎症之火,甚至可能在某些阿尔茨海默病和渐冻症病例中扮演着幕后黑手的角色。
这个将逆转录转座子与神经退行性疾病(神经细胞功能衰退或死亡的疾病)联系起来的理论仍在发展中。即使是该理论的支持者,虽然态度乐观,却也仍然保持谨慎立场。“这还远未成为主流观点,” 纽约州立大学石溪分校文艺复兴医学院的神经生物学家乔什·杜布瑙 (Josh Dubnau) 坦言。而且,逆转录转座子也无法解释所有神经退行病例。
然而,不断累积的证据表明它们可能是部分病例的根源。目前,在对人类脑组织、果蝇和小鼠进行了十多年的相关研究后,科学家们终于将他们的想法推向终极测试:在渐冻症、阿尔茨海默病及相关疾病患者中开展临床试验。这些试验借鉴了治疗HIV病毒药物库中的抗逆转录病毒药物,并已产生初步但充满希望的结果。
与此同时,科学家们仍在探索这些“病毒移民”的苏醒如何演变成全面爆发的疾病。杜布瑙等人将这一过程称为一场“逆转录转座子风暴”。
SAIXIANSHENG
会“跳跃”的基因
逆转录转座子是一种“跳跃基因”。这些DNA片段能在基因组中四处“搬家”。它们通过复制自己或把自己从某个位置“剪切”下来,然后“粘贴”到新的位置。逆转录转座子属于“复制-粘贴型选手”。
许多逆转录转座子都是我们古老的伙伴。杜布瑙说,有些甚至在智人(Homo sapiens)演化出来之前,或者在动植物分化之前就存在了。他认为,它们的祖先可能一直在“搭便车”(嵌入宿主染色体)和“自由身”(染色体外存在)两种状态间切换。
历经漫长岁月,一些逆转录转座子仍保留着在人类DNA中“蹦跶”的能力。它们使用一种叫做逆转录酶(reverse tranase) 的酶来复制自己(HIV等病毒也使用这种酶将RNA序列复制成DNA)。一旦完成复制,这些“病毒余孽”就能“跳跃”到染色体上的新位置。
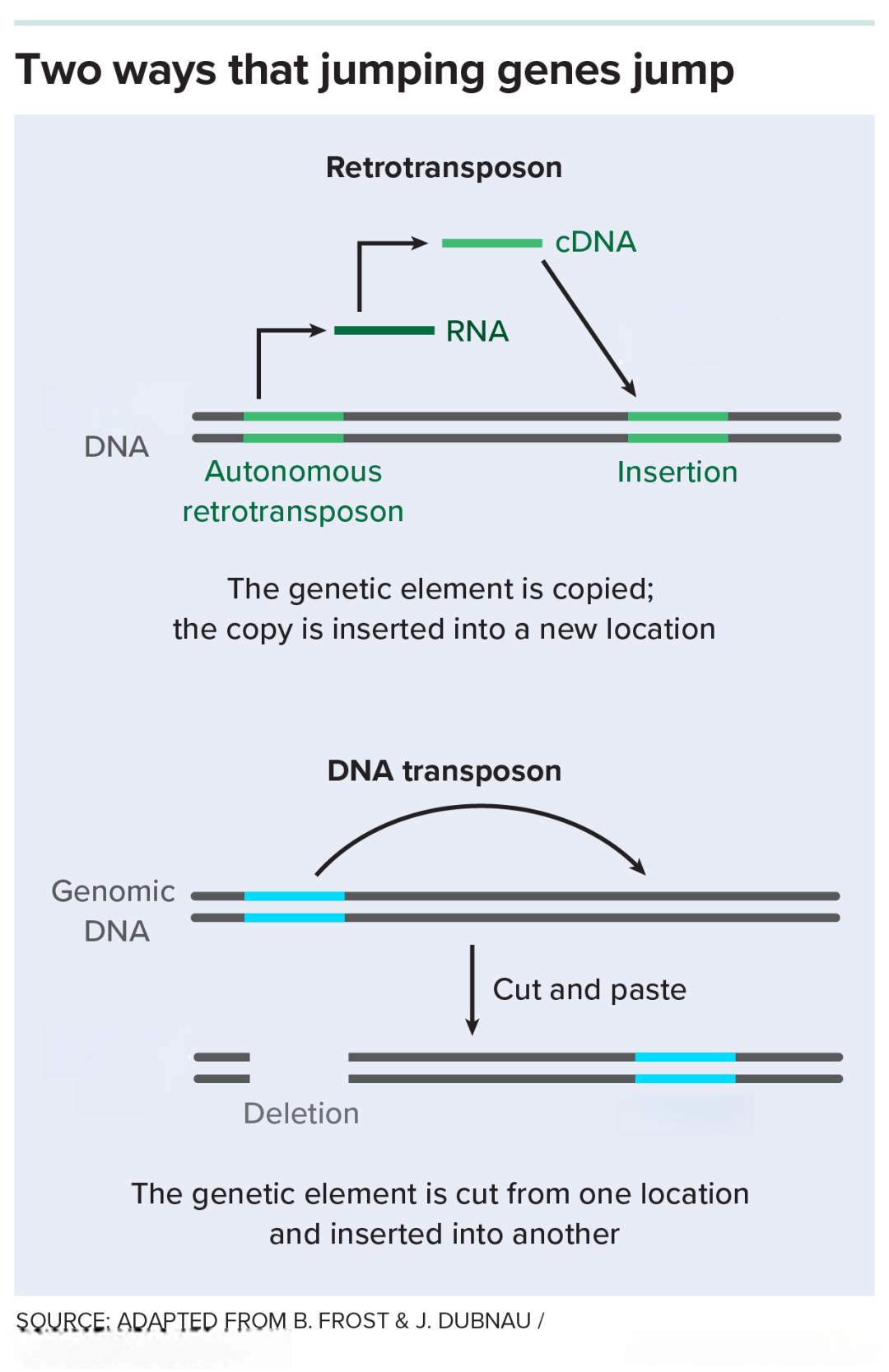
“跳跃基因”“蹦哒”的两种方式:简单来说,第一种方式中逆转录转座子可以通过转录出RNA,再将其逆转录为cDNA的方式,拷贝出自身的复制体,之后复制体会插入到基因组中的某些区域,实现“逆转录→转座”的基因跳跃方式;第二种方式中DNA转座子会直接将自己从基因组中“切下来”,并插入到另一个适合“安家落户”的区域,实现直接转座的基因跳跃方式。
想到基因组里布满了具有“蹦跳”能力的逆转录病毒基因,是不是有点毛骨悚然?但温尼伯曼尼托巴大学的杜维尔表示不必担心。奇妙的是,有些逆转录转座子已经“洗心革面”,做起了有益工作,比如协助身体完成维持干细胞、促进胚胎和神经系统的发育等任务。
而且,许多逆转录转座子本身要么“沉睡”着(休眠),要么已经“残废”(损坏)。细胞也有办法让它们(大部分时间)保持沉默。一个妙招是把它们“锁”在DNA中缠绕得异常紧密的区域里,这样,负责复制基因的分子机器就无法靠近它们了。
本质上讲,细胞把这些“不安分子”塞进了衣橱,然后砰地关上了门!
但越来越多的证据表明,随着人们年龄增长,这个“柜门”可能会嘎吱作响,让逆转录转座子“溜”出来。它们溜出来后具体搞什么破坏还不完全确定。一些科学家认为,问题主要不在于它们在基因组里到处“乱蹦”导致基因突变,而在于它们产生的那些类似病毒的RNA和蛋白质可能会严重扰乱正常的细胞活动。
罗德岛州普罗维登斯市布朗大学的神经生物学家贝丝·弗罗斯特(Bess Frost) 解释道:“我认为当转座子被激活时,真正驱动毒性的原因是它们制造了大量在细胞看来就是病毒的东西。”细胞做出防御性的炎症反应相当合理,而这种炎症反应恰恰与神经退行性疾病互相关联。
更糟的是,逆转录转座子似乎还会与那些早就被认为与神经退行有关的“流氓蛋白”联手,共同损伤或杀死神经细胞,这可能成为点燃疾病的“第一把火”。
SAIXIANSHENG
与渐冻症(ALS)的关联
科学家们早就怀疑病毒与渐冻症(导致控制运动的运动神经元退化)之间存在联系。但当这种联系最终被发现时,却出乎所有人的意料。
在21世纪初,科学家报告称,一些渐冻症患者血液中检测出病毒的逆转录酶,少数患者的脊髓液中也存在这种酶。有些患者的逆转录酶水平甚至与感染了HIV的人相当。
但杜布瑙回忆说:“当时,谁也找不到病毒本身。”
终于,杜维尔和同事们在一些死于渐冻症的患者大脑中,发现了证据——一种名为HERV-K 的逆转录转座子(一种“病毒残骸”)。由此,科学家们开始构建证据链,将“跳跃基因”与人类渐冻症、实验室动物和培养皿中的细胞联系起来。2017年,一个研究团队报告称,在某些渐冻症患者的大脑中,大量跳跃基因被激活了。
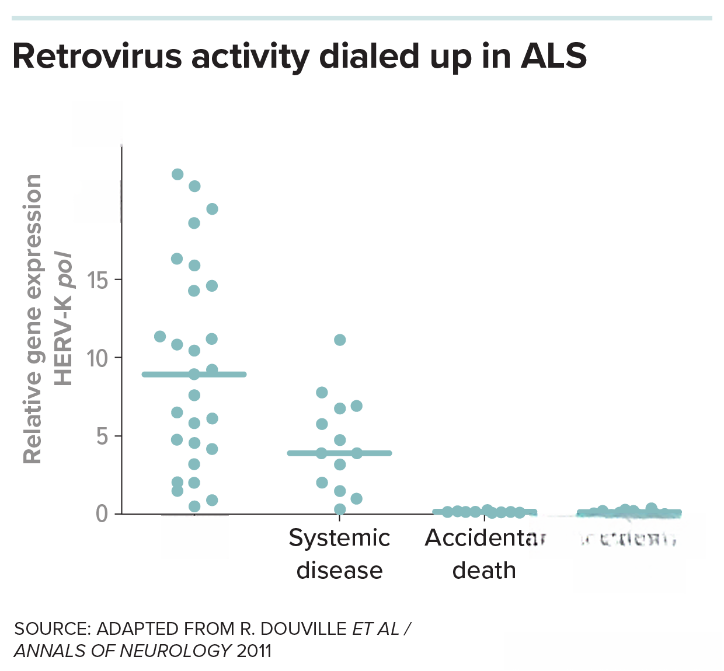
在首批将逆转录病毒与神经退行性疾病关联的研究中,研究人员通过对比死于渐冻症和其他病因的死者脑组织发现,HERV-K逆转录病毒的基因在ALS患者脑组织中已被激活。尤其在多数ALS样本中,一种名为pol(聚合酶)的HERV-K基因(该基因参与逆转录病毒基因组的复制过程)活性显著增强。
杜维尔的同事们还记录了HERV-K造成的破坏:当他们把这种逆转录转座子中的一个基因植入小鼠体内后,小鼠的神经细胞突触开始萎缩,并表现出渐冻症样的症状。
当科学家们聚焦于“是什么唤醒了HERV-K”时,一个熟悉的蛋白质现身了。它叫做TDP-43,之前就被认为与渐冻症相关联。但更早之前,人们就发现它参与了细胞对逆转录病毒(如HIV)的反应。
科学家们在20世纪90年代发现,TDP-43在细胞核内工作,它能抑制HIV基因的激活,同时也调控着那附近的人类基因。然而,在渐冻症或相关疾病(额颞叶痴呆,FTD)患者的神经元中,TDP-43会“叛逃”出细胞核,跑到细胞质里形成异常团块。这些团块不仅与多种神经退行疾病有关,还能在细胞间传播。而当TDP-43“擅离职守”后,也会在基因调控方面产生空缺,使许多基因的活性水平失调。
“变坏的”TDP-43本身就足以导致神经退行,但研究也表明,它“抛弃”核内职责的行为还会唤醒逆转录转座子。一项针对死于渐冻症或额颞叶痴呆患者脑细胞的研究揭示:当TDP-43离开细胞核后,某些逆转录转座子附近原本紧紧缠绕的DNA开始松动、解开。研究人员在培养的细胞中也观察到,TDP-43的缺失让某些逆转录转座子挣脱了束缚。换句话说,原本紧闭的“柜门”现在只是虚掩着,让这些“跳跃基因”得以溜出来并在基因组中蹦跶。
与此同时,杜布瑙和合作者正在研究大鼠、小鼠和人类中TDP-43及其控制基因的数据。他们发现TDP-43能自然地附着于多种跳跃基因的RNA,这表明正常的TDP-43即使在这些基因已经设法复制成RNA后,仍能继续控制住它们。而在额颞叶痴呆患者以及体内TDP-43含量异常(高或低)的啮齿动物中,这种相互作用被破坏了——看起来就像TDP-43再也无法控制这些跳跃基因了。
杜布瑙团队还转向了果蝇研究。他们在2013年至2023年间发表的一系列论文中报告:衰老和人类TDP-43基因都能导致果蝇大脑中的逆转录转座子“溜出染色体衣橱”,诱使脑细胞杀死邻近细胞,引发神经退行性病变。更甚的是,某些逆转录转座子的激活也会导致TDP-43在细胞核外聚集,形成了一个恶性循环:TDP-43和逆转录转座子相互强化对方的异常行为。杜布瑙表示:“一旦过了某个临界点,它就彻底失控了。”
综合这些发现,杜布瑙描绘了渐冻症发展的可能路径:正常情况下,细胞核内的TDP-43协助镇压逆转录转座子。但如果衰老或其他干扰导致TDP-43离开细胞核,那些曾经保持沉默的逆转录转座子就会“满血复活”,生产出病毒样的RNA和蛋白质。这些“活蹦乱跳”的基因本身就能通过插入新的DNA位置或引起炎症来诱发疾病,同时它们还会作用于TDP-43:迫使更多的TDP-43离开细胞核,在细胞质中形成团块,导致更严重的神经退行,并扩散至邻近细胞。
这并非导致所有类型渐冻症的原因,因为渐冻症是一种复杂的疾病,可能由多种诱因引发。但在2019年一项针对死后脑组织样本的研究中,杜布瑙和同事发现,大约五分之一的渐冻症患者存在高度的逆转录转座子激活和TDP-43功能障碍。
SAIXIANSHENG
与Tau蛋白与阿尔茨海默病的联系
就在渐冻症的故事逐步展开时,其他科学家也在追寻逆转录转座子与神经退行中另一个“恶名昭彰”的毒性蛋白——Tau蛋白之间的联系。在阿尔茨海默病患者的大脑中,Tau蛋白会扭曲成难以收拾的缠结。弗罗斯特指出,和TDP-43一样,Tau蛋白也在“看守”逆转录转座子、让它们保持安静方面扮演着重要角色。
这种“看守”作用源于Tau蛋白与细胞内部骨架(细胞骨架)的联系。这个骨架在物理层面连接着细胞核的骨架结构,而核骨架又固定着那些紧紧缠绕、用以沉默逆转录转座子的DNA区域。当Tau蛋白发生异常时,它会改变细胞主要骨架的结构,使其变得更僵硬。弗罗斯特和同事发现,这种结构缺陷会一直传递到核骨架和染色体上——就像拉紧网子一边的绳子会改变网子另一边的形状一样。
这种结构效应会解开果蝇染色体上紧密缠绕的片段,从而损害它们的神经元,弗罗斯特在2014年报告了这一现象。到2018年,她进一步发现tau蛋白异常会导致果蝇体内跳跃基因被激活。
“它们真的在‘跳’!”她说,这些基因从它们原本的染色体位置,跳跃到果蝇脑细胞的其他位置。而这些“蹦跶”的基因促成了神经细胞的死亡。
弗罗斯特团队同时也在哺乳动物小鼠模型中展开研究。2022年,他们报告称,在Tau蛋白功能失调的小鼠中,逆转录转座子同样被激活了。
与此同时,弗罗斯特和其他人检查了一些死于Tau相关疾病(如阿尔茨海默病)患者的大脑细胞,同样发现了被激活的逆转录转座子。
根据另一团队于2022年发表的研究,逆转录转座子的这种“觉醒”似乎发生在疾病的早期阶段。在那些即将发展为阿尔茨海默病的人的血样中,就在他们的症状恶化到足以被诊断为阿尔茨海默病之前,逆转录转座子基因转录成RNA的数量激增,形成了一场标志性的“逆转录转座子风暴”。
SAIXIANSHENG
来自HIV治疗的策略
不断累积的证据表明,重新激活一度沉睡的逆转录转座子——无论是因为TDP-43还是Tau蛋白功能失常——都能掀起一场混乱的风暴。因此,一个潜在的治疗方案立刻浮现在科学家们的脑海中:既然这些逆转录转座子很像病毒, 抗病毒药物或许能帮上忙。
巧的是,医生们已经有对付逆转录病毒的药物了:数百万人正在服用抗逆转录病毒药物来抑制HIV,或阻止它侵入细胞。
果然,过去几年的多项研究调查了源自HIV治疗方案的、能阻断逆转录酶的药物。在细胞、果蝇和小鼠实验中,这些药物成功抑制了逆转录转座子的活性,并缓解了神经退行病变。
这些药物作用明确,总体安全,并且已经进入针对神经退行性疾病的临床试验阶段。例如,研究人员在40名渐冻症患者中测试了一种为期24周的抗逆转录病毒疗程的安全性。结果显示不仅大多数患者安全完成了试验,而且他们血液中的HERV-K水平下降了,其渐冻症症状的进展似乎也有所延缓(2019年报告)。
弗罗斯特最近发表了一项小规模试验结果:12名早期阿尔茨海默病患者服用了24周的逆转录酶抑制剂。她的主要目的是评估治疗是否安全(结果证实是安全的),与此同时研究人员还观察到,受试者脑脊液中炎症标志物水平下降了。
杜布瑙和弗罗斯特都担任着Transposon Therapeutics公司的科学顾问委员。该公司在42名渐冻症和/或额颞叶痴呆患者中测试了其自主研发的逆转录酶抑制剂。公司宣称该药物耐受性良好,并显示出神经退行和炎症减轻的迹象,同时延缓了症状不可避免的恶化。公司正计划进行更大规模的试验,并打算在渐冻症、阿尔茨海默病以及进行性核上性麻痹(PSP,一种基于Tau蛋白的相关疾病)患者中测试其药物。
最近,弗罗斯特和杜布瑙共同在《神经科学年度综述》(Annual Review of Neuroscience) 上总结了这一领域的研究进展。他们都不认为单靠抗逆转录病毒药物就能解决由转座子驱动的阿尔茨海默病或渐冻症问题。正如杜维尔所指出的,这些药物设计时只针对特定的酶,但它们对逆转录转座子的其他基因、RNA或蛋白质(也可能引发损害神经的炎症)无能为力。
与此同时,证据不断积累表明:逆转录转座子可能还参与了其他神经退行性和炎症性疾病(如帕金森病和多发性硬化症)的发生,科学家们的目光已不再局限于渐冻症和阿尔茨海默病。
“这个领域的研究正在加速!”弗罗斯特说。
名词解释:
转座子(Transposon):亦称转座元件或“跳跃基因”,是一类可在基因组内重新定位的可移动遗传元件——其本质为具有自主位置改变能力的DNA核酸序列。
逆转录转座子(Retrotransposon):逆转录转座子是通过将转录的RNA通过逆转录转换为DNA,从而在宿主基因组中移动的可移动元件。
逆转录病毒(Retrovirus):逆转录病毒是一类特殊的病毒,它能将自己RNA基因组的DNA副本注入所入侵的宿主细胞DNA中,从而永久改变该细胞的基因组结构。
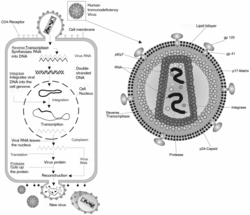
(以HIV为例)
人类内源性逆转录病毒K (Human endogenous retrovirus K, HERV-K):亦称人畸胎瘤源性病毒(HDTV),是一类与睾丸恶性肿瘤(特别是睾丸畸胎瘤)存在关联的内源性逆转录病毒家族。
反式激活效应DNA结合蛋白43(TAR DNA-binding protein 43,TDP-43):是一种由TARDBP基因编码的人体蛋白质。
Tau蛋白(τprotein):Tau 蛋白是由MAPT基因(微管相关蛋白tau基因)通过选择性剪接产生的六种高溶性蛋白质亚型。这类蛋白主要发挥维持轴突微管稳定性的作用,在中枢神经系统神经元中含量丰富——其中大脑皮层分布密度最高。它们在其他部位较为罕见,但也以极低水平表达于中枢神经系统的星形胶质细胞与少突胶质细胞中。
本文原文标题为“How rogue jumping genes can spur Alzheimer's, ALS”,2025年6月17日首发于Knowable Magazine, 《赛先生》获授权翻译并发布。
