一、罕见肿瘤的现状与挑战:被忽视的 “沉默杀手”
肿瘤作为全球公共卫生的重大威胁,其发病率和死亡率持续攀升。在我国,每年约 480 万新发肿瘤患者中,20%(约 78 万)属于罕见肿瘤。这类肿瘤因发病率低、病理机制复杂、临床表现多样,常面临诊断延迟、治疗手段有限的困境。例如,神经母细胞瘤虽为儿童最常见的颅外实体瘤,但仅占儿童肿瘤的 7%-10%;胃印戒细胞癌作为胃癌的特殊亚型,恶性程度极高,早期易转移,5 年生存率不足 30%。
我国在 2023 年更新的罕见病目录中,罕见肿瘤从首批的 4 种增至 20 余种,涵盖神经母细胞瘤、胶质母细胞瘤、恶性胸膜间皮瘤等。然而,由于缺乏大规模临床数据,这类肿瘤的诊疗常依赖个案经验或借鉴相似癌种的方案,导致疗效参差不齐。传统治疗手段(手术、化疗、放疗)在罕见肿瘤中往往面临耐药性、毒性累积或微小残留病灶(MRD)复发等问题,亟需创新疗法突破瓶颈。
二、NK 细胞疗法的生物学基础:天然免疫的 “肿瘤猎手”
自然杀伤细胞(Natural Killer Cell, NK 细胞)是人体天然免疫的核心效应细胞,占外周血淋巴细胞的 5%-15%。与依赖抗原致敏的 T 细胞不同,NK 细胞无需预先激活即可直接识别并杀伤肿瘤细胞,其作用机制主要包括:
- 受体介导的识别机制:抑制性受体(如 KIR、CD94/NKG2A)识别正常细胞表面的 MHC-I 分子,维持自身耐受;激活性受体(如 NKG2D、NKp30/46)识别肿瘤细胞表面的应激分子(如 MICA/B、ULBP)或异常糖蛋白,启动杀伤程序。
- 多重杀伤途径:穿孔素 - 颗粒酶途径:通过释放穿孔素在肿瘤细胞膜形成孔洞,颗粒酶进入细胞诱导凋亡;死亡受体途径:通过 FasL 或 TRAIL 与肿瘤细胞表面受体结合,激活凋亡信号通路;细胞因子分泌:分泌 IFN-γ、TNF-α 等细胞因子,增强免疫应答并抑制肿瘤微环境。
NK 细胞的独特优势在于其广谱抗肿瘤活性和低免疫原性,尤其适合用于对传统治疗耐药或无法耐受的罕见肿瘤患者。此外,异体 NK 细胞疗法(如脐带血来源、CAR-NK)可避免自体细胞因肿瘤微环境抑制导致的功能耗竭,成为当前研究热点。
三、临床突破:NK 细胞疗法在罕见肿瘤中的实证案例
(一)神经母细胞瘤:儿童罕见肿瘤的生存希望
神经母细胞瘤起源于交感神经系统,约 50% 的高危型(HR-NB)患者会在治疗后复发,且对化疗耐药。2024 年发表于《Scientific Reports》的 I 期临床研究(NCT 编号未公开)评估了异体 NK 细胞治疗复发 / 难治性神经母细胞瘤的安全性与疗效 [1]。

- 研究设计:纳入 4 例接受自体干细胞移植后复发的患儿,静脉输注扩增的异体 NK 细胞(剂量:1×10^6 cells/kg),每 2 周 1 次,共 6 次。
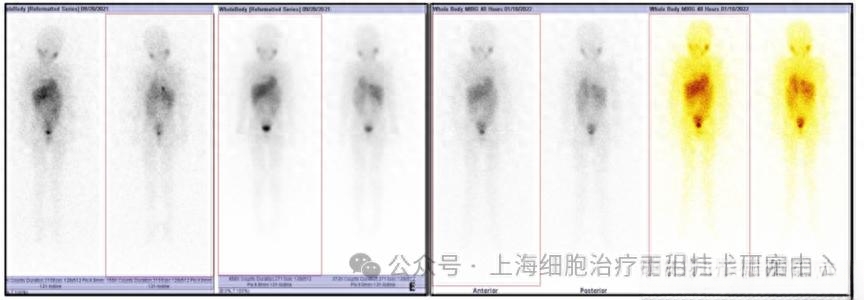
- 关键结果:完全缓解(CR)病例:5 岁女孩,确诊后接受化疗 + 自体干细胞移植无效,转移灶累及骨骼及软组织。NK 细胞治疗 4 个月后,PET-CT 显示肿瘤体积缩小 50%;13 个月后,MIBG 扫描显示转移灶完全消失,实现 CR,至今无病生存 31 个月。部分缓解(PR)病例:4 岁男孩,移植后 11 个月出现骨转移,治疗初期病情进展,但调整剂量后 3 个月评估显示病灶缩小 30%,PR 持续 9 个月。
- 机制分析:NK 细胞通过识别肿瘤细胞表面高表达的 NKG2D 配体(如 MICA),有效清除 MRD,且治疗过程中未出现严重细胞因子释放综合征(CRS)或移植物抗宿主病(GvHD)。
(二)胃印戒细胞癌:打破 “癌中之王” 的生存僵局
胃印戒细胞癌因癌细胞含大量黏液、侵袭性强,常被称为 “隐形杀手”。传统化疗对其疗效有限,且易导致免疫功能损伤。2021 年《Medicine》杂志报道的个案 [2] 展示了 NK 细胞疗法的独特价值:
- 病例详情:62 岁男性,因呕吐 1 年确诊胃印戒细胞癌(T3N1M0),肿瘤大小 7×6×1.8cm,术后接受 XELOX 化疗 6 周期。2016 年 9 月复查发现 CA72-4 升高(12.5 U/mL),且外周血 CD4+/CD8 + 比值倒置(0.8),提示免疫抑制。
- 治疗方案:2016 年 11 月起,每年接受 3 次自体 NK 细胞回输(每次 1×10^8 cells),联合低剂量 PD-1 抑制剂。
- 疗效评估:治疗 3 个月后,CA72-4 降至正常范围(<6.9 U/mL);46 个月随访期间,CT 未见复发或转移,实现持续无病生存(DFS),突破该亚型平均生存期(约 12-18 个月)的极限。
- 联合机制:NK 细胞通过清除循环肿瘤细胞(CTCs)和化疗耐药克隆,与 PD-1 抑制剂协同逆转肿瘤微环境中的免疫抑制(如减少 Treg 细胞、M2 型巨噬细胞浸润)。
四、NK 细胞疗法的优势与挑战:从实验室到临床的跨越
(一)核心优势:超越传统治疗的免疫新范式
- 即时杀伤与广谱性:无需基因编辑或抗原致敏,可快速响应多种肿瘤(包括缺乏 MHC-I 表达的 “冷肿瘤”)。
- 低毒性与安全性:不攻击正常组织,避免化疗 / 放疗的骨髓抑制、消化道反应等毒性,适合老年或虚弱患者。
- 联合治疗的协同效应:与化疗、靶向药(如抗血管生成药物)或免疫检查点抑制剂联用,可增强肿瘤细胞对 NK 细胞的敏感性(如上调应激分子表达)。
(二)现存挑战:制约临床普及的关键瓶颈
- 细胞来源与扩增效率:自体 NK 细胞常因患者免疫功能低下导致体外扩增困难(如慢性淋巴细胞白血病患者);异体 NK 细胞存在异基因反应风险,需通过基因编辑(如敲除 KIR 基因)降低排斥。
- 肿瘤微环境逃逸:肿瘤细胞通过分泌 TGF-β、IL-10 等细胞因子抑制 NK 细胞活性;基质细胞或免疫抑制性细胞(如 MDSCs)形成物理屏障,阻碍 NK 细胞浸润。
- 标准化与成本问题:不同实验室的细胞制备工艺(如培养基、细胞因子组合)差异大,缺乏统一质量控制标准;单次治疗成本约 5-10 万元,长期应用(如每年 3 次)经济负担较重。
五、未来展望:NK 细胞疗法的优化路径与临床转化
(一)技术创新:提升细胞功能与靶向性
- 基因工程改造:CAR-NK 细胞:通过嵌合抗原受体(CAR)赋予 NK 细胞特异性识别肿瘤抗原的能力,如 CD19-CAR-NK 用于治疗 B 细胞恶性肿瘤,已在临床试验中显示初步疗效(NCT03056339);敲除抑制性受体:如敲除 KIR2DL1 基因,增强异体 NK 细胞对 MHC-I 阴性肿瘤的杀伤活性。
- 细胞因子优化:使用 IL-15 替代 IL-2 进行体外扩增,减少 T 细胞增殖并维持 NK 细胞干性;局部递送 IFN-γ 预处理肿瘤微环境,上调肿瘤细胞表面 NKG2D 配体表达。
(二)联合治疗策略:构建多维抗肿瘤网络
- 与表观遗传调控剂联用:如 DNA 甲基化抑制剂(5-aza-dC)可恢复肿瘤细胞 MICA/B 表达,增强 NK 细胞识别。
- 纳米药物递送系统:设计载药纳米颗粒同时递送化疗药物与 NK 细胞激活剂(如 CpG 寡核苷酸),实现 “化疗 - 免疫” 协同杀伤。
- 免疫代谢重编程:靶向肿瘤细胞的谷氨酰胺代谢通路(如抑制谷氨酰胺酶),削弱其对 NK 细胞的能量竞争。
(三)临床研究布局:从罕见肿瘤到广谱应用
目前,全球范围内 NK 细胞疗法相关临床试验已超 200 项(ClinicalTrials.gov 数据),主要聚焦于血液肿瘤(如急性髓系白血病)和实体瘤(如肝癌、卵巢癌)。针对罕见肿瘤的研究虽尚处早期,但初步数据已显示潜力:
- 神经母细胞瘤:美国 NCI 开展的 CAR-NK-92 疗法(靶向 GD2 抗原)II 期试验(NCT04666918)正在招募患者;
- 恶性胸膜间皮瘤:中国医学科学院肿瘤医院开展的自体 NK 细胞联合 PD-L1 抑制剂试验(ChiCTR2100052346)显示疾病控制率达 70%。
六、结语:免疫治疗新时代的曙光
从 2016 年首个异体 NK 细胞疗法获 FDA 批准开展临床试验,到如今在神经母细胞瘤、胃印戒细胞癌等罕见肿瘤中实现完全缓解,NK 细胞疗法正以其独特的作用机制和临床安全性,重塑肿瘤治疗格局。尽管面临细胞生产、耐药性等挑战,随着合成生物学、单细胞测序等技术的突破,NK 细胞有望与基因编辑、人工智能(如预测最佳治疗窗口的算法)深度融合,推动罕见肿瘤治疗走向 “精准免疫时代”。
未来,随着政策支持(如罕见病医保覆盖)和基础研究的深入,NK 细胞疗法或将成为继手术、放化疗、靶向治疗后的第四大支柱,为占肿瘤总数 1/5 的罕见肿瘤患者带来生存希望。正如《自然》子刊评论指出:“NK 细胞的‘天然杀手’属性,或许正是破解罕见肿瘤治疗困局的关键钥匙。”
